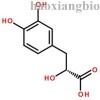
药理药效:
1 . 对心肌的作用: 丹参素具有缩小心肌梗死范围和减轻病程的作用, 同时对心肌缺血ö再灌注损伤具有保护作用。张力等报道丹参素为超氧阴离子 清除剂, 从而推测其可保护心肌线粒体免受氧自由基引发的脂质过氧化物的损伤。苏晓华等研究表明, 丹参素对大鼠心肌线粒体ADP/O , RCR 及细胞色素氧化酶具有保护作用, 提示丹参素为良好的•OH 清除剂, 并对大鼠心肌线粒体膜具有保护作用。丹参素对外源性O2有清除作用,减轻自由基对线粒体膜流动的影响,起到保护线粒体的功能。
2. 抑制血小板聚集及抗凝作用: 丹参素能明显抑制血小板的聚集, 并明显增加血小板膜的流动性, 提示其对冠心病有效。史举彤等报道, 丹参素可提高红细胞的负电荷, 使彼此不易聚集; 降低全血粘度, 抑制血小板聚集, 缴活纤溶酶系统; 增加红细胞膜的机械强度, 减少红细胞的破坏。大剂量丹参素可增加血管脆性, 这可能与丹参素具有抗血小板聚集和促进纤维降解功能有关。丹参素可提高机体的纤溶活性,改善血液流变性、提高红细胞的变形能力和调解血液的粘滞度,改善全身各脏器(尤其是药物首先到达的心脏、肝脏、肺脏和胰腺)的微循环障碍,有助于机体组织的康复和成人呼吸窘迫综合征等严重并发症的纠正。
3 . 抗菌消炎及增强机体免疫作用: 丹参素阻止钙离子内流, 显著抑制大鼠腹腔巨噬细胞产生前列腺素E2 (DGE2) 及血栓丸B2 (TXB2)。通过体外实验观察丹参素对单核巨噬细胞产生细胞因子的调节作用,结果发现丹参素能激活单核巨噬细胞分泌肿瘤坏死因子(TNFα)、IL-1、IL-6、IL-8因子,但分泌的量较内毒素刺激单核巨噬细胞的量少。另据王文俊等报道, 丹参素能显著抑制由内毒素诱导的上述因子的大量分泌(P < 0. 05) , 具有抗炎及增强机体免疫作用。在临床上对感染性休克患者应用丹参素,可望提高生存率。
4. 抗动脉粥样硬化及降血脂作用: 丹参素抑制细胞内源性胆固醇的合成, 还具有抗脂质蛋白氧化作用,降低血胆固醇, 因此具有保护血管屏障, 防止脂质沉积及动脉粥样硬化(AS)作用。王南等研究表明丹参素对牛主动脉平滑肌细胞氧化修饰低密度脂蛋白(LDL ) 具有抑制作用。近代研究发现,过亚硝酸根是动脉硬化等疾病的重要介导者 。廖力夫等实验证明当丹参素存在时,就能有效保护机体免受过亚硝酸根损伤,防止动脉粥样硬化的形成。丹参素具有抑制细胞氧化修饰LDL 的作用,其抗氧化能力与丹参素的量呈正相关,提示丹参素可用于动脉粥样硬化的防治。
5. 抗血栓形成作用:严常开等研究丹参素的活血化瘀作用,发现丹参素能明显抑制由ADP诱导的大鼠血小板体外聚集活性,延长电刺激大鼠颈总动脉后血栓形成时间,明显降低血瘀大鼠低、中、高切变率的全血黏度,血液黏度,红细胞压积,卡松屈服应力,红细胞电泳时间以及红细胞聚集指数。姜开余等用流式细胞仪测定由TNFα,fMLP和凝血酶诱导细胞表面细胞黏附分子的表达,结果显示丹参素呈剂量依赖性抑制fMLP诱导的粒细胞表达CDllb,对TNFα诱导的人脐静脉内皮细胞表面VCAM-1,E-selectin的表达可产生明显的抑制作用,表明丹参素对细胞因子活化内皮细胞有抑制作用,从而有利于保护血管内皮细胞,减少白细胞黏附,提示这可能其发挥抗血栓形成作用的机制之一。金昔陆等观察8种丹参素衍生物对体外ADP诱导兔血小板聚集的影响,结果显示8种衍生物可明显抑制ADP诱导的家兔血小板聚集作用,且明显增加30min有效解聚率。http://www.haoxiangbio.com
丹参素预防脑血栓的发生 丹参素可通过对血小板释放物及凝血酶原的影响,抑制其聚集,降低血液的凝固性而起到活血化淤的作用。费丽萍[ 2 ]等实验证明,丹参素具有钙拮抗作用,通过抑制红细胞膜上的电压依赖通道,抑制红细胞的钙内流,使细胞内钙水平降低,使红细胞变形能力增强。它还可提高红细胞的负电荷,使彼此不易聚集;降低全血粘度,激活纤溶酶系统。由于丹参素在心、肾、脑的分布浓度高,连同对血液的这些影响,提示丹参素可预防脑血栓的发生。
6. 防止创面的过度愈合,对增生性疤痕的治疗作用:最近,由西安市中心医院烧伤整形外科和第四军医大学西京医院整形外科,联手完成的一项西安市科技社会发展计划基金资助项目证明,生肌散中的单方丹参素对肉芽组织中的成纤维细胞有抑制作用,可防止创面的过度愈合。从研究中可以看出,丹参素促进伤口愈合并非直接促进成纤维细胞增殖而发挥作用,很有可能是通过改善微循环、改变伤口局部微环境、提供能量代谢物质、促进代谢产物的清除而发挥作用。当然,因为具有抑制肉芽组织中成纤维细胞增殖的功能,故在伤口愈合早期用药量需要控制,而在伤口愈合后则可加大其剂量以便抑制成纤维细胞的过度增殖,防止瘢痕形成。姜会庆等实验证实丹参素具有诱导成纤维细胞发生凋亡的作用。其机理可能为:1) 影响控制细胞增殖和凋亡的基因表达;2) 激活核酸内切酶,使DNA 链断裂而诱发凋亡。另外,丹参素具有调节核转录因NF 一1 结合活性而起到减少成纤维细胞的胶原合成和分泌作用。
7. 扩张冠状动脉作用:丹参素能明显扩张冠状动脉,使冠状动脉的血流量显著增加,并能对抗吗啡、心得安等的缩冠脉效应。
8. 治疗肝损伤的作用:丹参素可以在一定范围内呈剂量依赖性地直接刺激体外培养小鼠肝细胞的增殖,表明丹参素还有促进肝细胞修复再生的作用。丹参素通过降低ET含量,上调eNOS表达、下调iNOS的表达调节NO含量,减轻肝脏血管收缩,抑制血小板聚集,改善受损肝脏微循环障碍,从而减轻急性重型肝损伤。李跃华等试验证明:用丹参素则可明显改善肝细胞线粒体的功能,减轻肝细胞的损伤、坏死。因此,丹参素在D - 半乳糖胺致肝细胞损伤时对肝细胞的保护作用机制可能与稳定生物膜、维持钙稳态有关,这有待进一步研究。李菁等实验研究,氰化钾对肝细胞具有毒性,丹参素能使2. 5 mmol/ L 氰化钾肝细胞培养液中LDO含量,提示氰化钾致肝细胞损伤与自由基毒性作用密切相关,丹参素具有稳定细胞膜清除自由基的作用。张振玉等用四氯化碳损伤肝细胞造模实验显示中高剂量组可降低Hyp 及胶原含量,并与其抑制细胞增殖活性相一致。提示丹参素可抑制肝纤维化。其作用机制可能是丹参素能够诱导成纤维细胞的凋亡。
9. 抗脑缺血损伤作用 丹参素可明显缩小脑梗死面积,改善神经功能缺损,并减少脑水含量。丹参红花注射液 (7.2、14.4 mg/kg)能明显减轻大鼠急性脑缺血所引起的脑指数、脑含水量的病理变化,同时降低脑内毛细血管通透性,维持脑组织神经细胞形态结构的正常。超短波治疗、丹参治疗及二者合用均能减轻大鼠缺血侧脑含水量,提高抗氧化酶超氧化物歧化酶(SOD)含量,降低自由基产物丙二醛(MDA)的含量,3个治疗组之间差异不显著。表明超短波治疗与丹参治疗对大鼠局灶性脑缺血再灌注损伤具有神经保护作用,此作用可能与减轻脑水肿、升高SOD和降低MDA有关。采用缺血缺氧的血管内皮细胞模型,应用化学发光法观察培养液中次黄嘌呤的含量,发现丹参组可减少次黄嘌呤的增加,并通过相差显微镜发现丹参组内皮细胞形态完好。丹参素可抑制缺氧、缺糖损伤所致的线粒体膜电位的降低,从而具有稳定线粒体膜电位的作用,抑制细胞凋亡的发生:这种作用可能与其能抑制神经细胞内钙
10. 丹参素对肺心病的治疗 丹参素具有扩张动脉的作用,并且可抑制血小板释放收缩物质。丹参素浓度在1. 25~5 g/ L 时均能抑制HPV。且剂量越大,抑制作用越强,最后达到完全抑制。比较同等剂量的丹参素,复方丹参注射液及丹参注射液对HPV 的作用,结果丹参素作用最强。提示丹参素可能为肺心病、成人呼吸窘迫综合征(ARDS)等危重疾病的治疗提供帮助。
11.丹参素抗肿瘤作用 丹参素的抑癌作用可能是其抗癌作用的原因之一。眭建等[ 8 ]实验结果显示丹参素在无血清培养液中具有明显的抑癌作用(与阴性对照组和丹参组相比, P值均< 0. 05) ,当丹参素中浓度达80 mg/ ml 时,其抑癌效应与Aclacinomycin A 相同( P > 0. 05) 。丹参素抑制胃腺癌细胞株的机制与阻断肿瘤细胞胆固醇合成途径有关。
12.丹参素对高原病的防治 高原病是高原缺氧使机体生理代偿(失代偿) 所致组织和器官负荷加重(病理改变) 而出现的临床症候群,主要原因是高原缺氧所至。张广明等证明丹参素能有效的清除低氧引起的异常增加的氧自由基、提高机体组织的携氧能力、抑制高原缺氧所至的低氧性肺动脉收缩、保证心、脑等重要器官的氧供应。总之丹参素能提高血液的携氧能力,延长机体耐受缺氧的能力,有效的减轻低氧所致的心脑肾肺等重要器官的损伤,为高原病的防治提供了依据。
13.丹参素对银屑病的治疗作用 粘附分子与银屑病的发病具有比较密切的关系,丹参素可影响粘附分子的表达。吴京海等实验结果初步显示,寻常型银屑病患者PBMC 表面ICAM - 1 的表达明显升高,而经丹参素处理后,其表达有显著下降,说明丹参素具有抑制ICAM - 1 表达的作用。丹参素与银屑病PBMC 孵育后,其与HUVEC 的粘附减弱,这同样也提示丹参素可能通过抑制PBMC 与血管内皮细胞的粘附而达到治疗银屑病的效果。另外,在正常人中,丹参素对PBMC与内皮细胞的粘附及粘附分子的表达无显著影响。此实验提示丹参素可通过降低粘附分子的表达治疗银屑病。