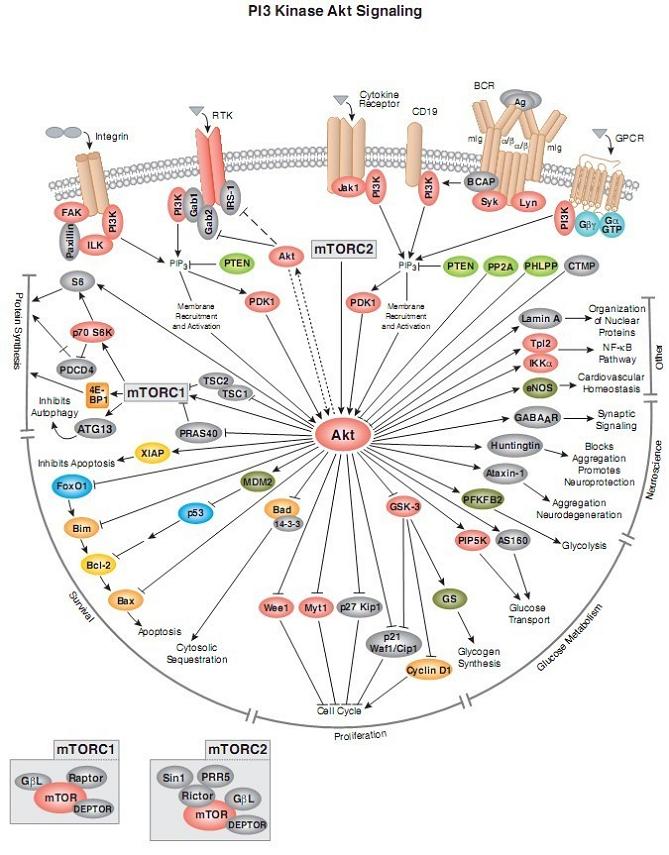
磷脂酰肌醇3-激酶(PI3Ks)信号参与增殖、分化、凋亡和葡萄糖转运等多种细胞功能的调节. 近年来发现, IA型PI3K和其下游分子蛋白激酶B(PKB或Akt)所组成的信号通路与人类肿瘤的发生发展密切相关. 该通路调节肿瘤细胞的增殖和存活, 其活性异常不仅能导致细胞恶性转化, 而且与肿瘤细胞的迁移、黏附、肿瘤血管生成以及细胞外基质的降解等相关, 目前以PI3K-Akt信号通路关键分子为靶点的肿瘤治疗策略正在发展中.
在PI3K家族中, 研究最广泛的是能被细胞表面受体所激活的I型PI3K. 哺乳动物细胞中Ι型PI3K又分为IA和IB两个亚型, 他们分别从酪氨酸激酶连接受体和G蛋白连接受体传递信号.IA 型PI3K是由催化亚单位p110和调节亚单位p85所组成的二聚体蛋白, 具有类脂激酶和蛋白激酶的双重活性.PI3K通过两种方式激活, 一种是与具有磷酸化酪氨酸残基的生长因子受体或连接蛋白相互作用, 引起二聚体构象改变而被激活; 另一种是通过Ras和p110直接结合导致PI3K的活化. PI3K激活的结果是在质膜上产生第二信使PIP3, PIP3与细胞内含有PH结构域的信号蛋白Akt和PDK1(phosphoinositidedependentkinase-1)结合, 促使PDK1磷酸化Akt蛋白的Ser308导致Akt的活化. Akt还能通过PDK2(如整合素连接激酶ILK)对其Thr473的磷酸化而被激活.活化的Akt通过磷酸化作用激活或抑制其下游靶蛋白Bad 、Caspase9、NF-κB、GSK-3、FKHR、 p21Cip1和p27 Kip1等, 进而调节细胞的增殖、分化、凋亡以及迁移等.
PI3K-Akt信号通路的活性被类脂磷酸酶PTEN(phosphatase and tensin homolog deleted on chromosome ten)和SHIP(SH2-containing inositol 5-phosphatase)负调节, 他们分别从PIP3的3´和5´去除磷酸而将其转变成PI(4,5)P2和PI(3,4)P2而降解. 迄今为止, 尚未发现下调Akt活性的特异磷酸酶, 但用磷酸酶抑制剂处理细胞后, 发现Akt的磷酸化和活性均有所增加. 最近发现Akt能被一种C末端调节蛋白(CTMP)所失活, CTMP能结合Akt并通过抑制Akt的磷酸化而阻断下游信号的传递, CTMP的过表达能够逆转v-Akt转化细胞的表型. 热休克蛋白90(HSP90)亦能结合Akt, 阻止Akt被PP2A磷酸酶的去磷酸化而失活, 因此具有保护Akt的作用.
本信号转导涉及的信号分子主要包括
Integrin,FAK,Paxillin,ILK,PIP3,S6,p70S6K,RTK,Gab1,Gab2,IRS-1,PI3K,PTEN,AKT,PDK1,Cytokine Receptor,Jak1,CD19,BCR,Ag,BCAP,Syk,Lyn,GPCR,TSC1,TSC2,Gβγ,GαGTP,PP2A,PHLPP,CTMP,PDCD4,4E-BP1,ATG13,mTORC1,TSC1,TSC2,PRAS40,XIAP,FoxO1,Bim,Bcl-2,Bax,MDM2,p53,Bax,Bad,14-3-3,Wee1,Myt1,p27Kip1,p21Waf1/Cip1,CyclinD1,GSK-3,GS,Bcl-2,mTORC2,LaminA,Tpl2,IKKα,eNOS,GABAAR,Huntingtin,Ataxin-1,PFKFB2,PIP5K,AS160等。
Integrin,FAK,Paxillin,ILK,PIP3,S6,p70S6K,RTK,Gab1,Gab2,IRS-1,PI3K,PTEN,AKT,PDK1,Cytokine Receptor,Jak1,CD19,BCR,Ag,BCAP,Syk,Lyn,GPCR,TSC1,TSC2,Gβγ,GαGTP,PP2A,PHLPP,CTMP,PDCD4,4E-BP1,ATG13,mTORC1,TSC1,TSC2,PRAS40,XIAP,FoxO1,Bim,Bcl-2,Bax,MDM2,p53,Bax,Bad,14-3-3,Wee1,Myt1,p27Kip1,p21Waf1/Cip1,CyclinD1,GSK-3,GS,Bcl-2,mTORC2,LaminA,Tpl2,IKKα,eNOS,GABAAR,Huntingtin,Ataxin-1,PFKFB2,PIP5K,AS160等。
点击图中信号分子,查看详细通路图及产品(抑制剂,抗体,磷酸化抗体,检测试剂盒,重组蛋白等)